Nitrati, fosfati, nitriti, ammoniaca, DOM, POM, acido acetico, alcool, batteri, nitrificazione, aerobico, anossico, aaaaaaaaaaaaaaaaaaaaaaaaaah… di cosa stiamo parlando?
Bisogna essere dei chimici o dei biologi per gestire un acquario capendoci davvero qualcosa?
E’ complicato comprendere l’immagine riportata qui di seguito da un famoso sito?
 Fig. 1 – http://upload.wikimedia.org/wikipedia/commons/6/60/Ciclo_dellAzoto.jpg –
Fig. 1 – http://upload.wikimedia.org/wikipedia/commons/6/60/Ciclo_dellAzoto.jpg –
Cerchiamo con questo primo articolo di darvi qualche accenno di chimica e biologia, nella maniera più pratica possibile, ma anche cercando di trasmettere qualche nozione, per quanto ci sia possibile.
Gli inquinanti più comuni vengono classificati essere i nitriti, i nitrati, i fosfati, ma questi sono tre, di decine di centinaia di sostanze presenti in acquario.
Chimicamente sono composti, molecole, cioè sostanze costituite da più elementi chimici, uniti insieme da “attrazioni“.
Cosa sono gli elementi chimici? Sono sostanze anch’essi, naturalmente presenti nel nostro mondo, quindi derivanti dal cosmo e dai suoi misteri. quelli conosciuti sono raggruppati, secondo un ordine definito e regolato da proprietà “periodiche” (da cui il nome della tavola periodica degli elementi).
Tutti questi elementi, si combinano fra loro per ragioni di “completamento“, hanno cioè delle necessità che soddisfano attraendosi l’un l’altro e mantenendo legami chimici, questo processo porta alla formazione delle molecole.
L’attrazione è dovuta alla forza dei protoni, positivi, che attraggono gli elettroni, i quali gravitano irregolarmente intorno al nucleo positivo. L’attrazione dei protoni di un atomo sugli elettroni di un altro permette l’attrazione. I due atomi non collidono, poichè gli elettroni, fra di loro si respingono.
I nitriti, nitrati e tutti gli altri composti sono quindi molecole. Esaminiamole brevemente.
Nitriti, Nitrati – derivano dall’azoto legato chimicamente con l’ossigeno, come si deduce dalla formula chimica.
NO2– NO3–
Fosfati – derivano dal fosforo (P) legato chimicamente all’ossigeno.
PO43-
La formazione di questi ioni (molecole con cariche elettriche, cationi se positive, anioni se negative) è un po’ più complessa, ma niente paura.
Esaminiamo l’azoto, per gli altri è lo stesso.
N2 + O2 –> N2O5 (anidride nitrica)
N2O5 + H2O –> HNO3 (acido nitrico)
HNO3 –> H+(ione idrogeno) + NO3– (ione nitrato)
Non credo interessi il motivo per cui queste molecole sono così costituite, ma è interessante notare, come dall’azoto gassoso N2 , si formino, per reazioni chimiche successive una serie di sostanze.
Quindi tutti gli anioni (ioni la cui formula termina con cariche negative) derivano da acidi (sono infatti residui acidi).
Le sostanze chimiche hanno bisogno di stabilità (altrimenti sono appunto chimicamente reattive). Gli anioni (hanno una carica negativa poichè possiedono un elettrone aggiunto, strappato all’idrogeno, che difatti resta caricato positivamente).
La stabilità si trova “regolarizzando” la situazione elettronica.
Anione (elettroni in più) + Cationi (elettroni in meno) –> Sostanze neutre elettricamente (sali)
ad es. Na+ + Cl– –> NaCl
Tutto questo accade nell’acquario ad una velocità impressionante e per migliaia di molecole.
Chiamiamo reagenti le sostanze che reagiscono, prodotti quelle che derivano dalla trasformazione chimica.
I prodotti di reazione, che sono a tutti gli effetti sostanze nuove, potrebbero non essere solubili, nel solvente dei reagenti e quindi “precipitare”
Questo comporta che queste sostanze insolubili, restino come corpi di fondo (come un sasso nel fiume) nella vasca, chimicamente un po’ più inerti che in forma ionica. In realtà potrebbero ancora reagire ma per farlo dovrebbero rompere un legame stabile e quindi di difficile scissione.
Ecco quindi l’utilizzo del Kalkwasser (idrossido di calcio, Ca(OH)2 soluzione satura), lo ione calcio Ca++, che deriva dalla scissione della molecola Ca(OH)2 , viene sfruttato, sia per aumentare ll livello di calcio in acqua che per “precipitare” evetuali anioni, che formino con lui sostanze insolubili. Come ad esempio i fosfati.
Proprio sullo ione calcio la discussione si amplifica, poichè l’interesse acquariofilo cresce, vista la sua funzione nella crescita dello scheletro dei coralli duri, costituito per la maggiore parte da materiale calcareo, cioè carbonato di calcio e magnesio.
Qualsiasi acquariofilo, può infatti verificare questo, semplicemente addizionando ad un scheletro di una qualsiasi madrepora una soluzione acidula, quale potrebbe banalmente essere del succo di limone, aceto di vino o un acido come il muriatico (cloridrico). Lo sviluppo di bollicine confermerà la presenza dei carbonati data la reazione
CO3— + H+ –> H2CO3 –> H2O + CO2
La CO2, anidride carbonica o biossido di carbonio, è un gas e come tale si libera nella soluzione acquosa come bollicine.
Fig. 4 – scheletro di fungia –
L’acquariofilo marino, che quindi voglia cimentarsi nell’allevamento di madrepore, dovrà quindi preoccuparsi di mantenere costante la concentrazione dello ione calcio, ad una concentrazione il più simile possibile a quella dei mari ospitanti questi magnifici e stupefacenti animali.
Spieghiamo anche cosa si intende con “la concentrazione“.
Si intende come concentrazione la quantità di una determinata sostanza in una soluzione. Soluzione indica un miscuglio in cui una o più sostanze, soluti, vengono disperse in una sostanza, quasi sempre presente in quantità maggiore, chiamata solvente.
Il nome solvente e soluto in realtà deriva dal termine solvatazione. Fig. 5
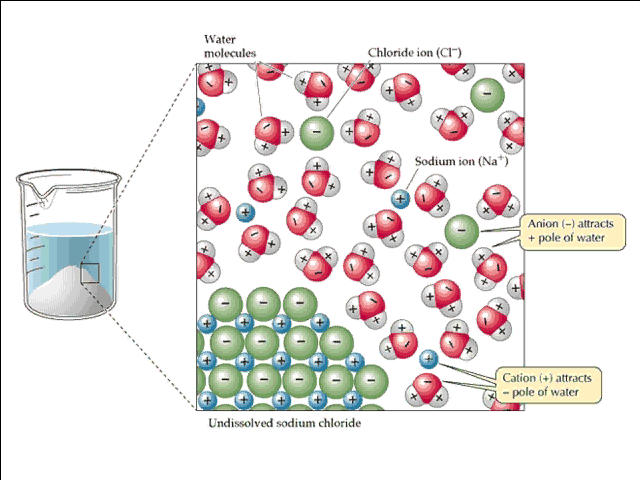 Fig. 5 – solvatazione dell’NaCl – http://withfriendship.com/images/h/37555/Solvation-image.gif
Fig. 5 – solvatazione dell’NaCl – http://withfriendship.com/images/h/37555/Solvation-image.gif
Proprio questa solvatazione, dell’NaCl accade anche nelle nostre vasche, in cui il sale più presente è il cloruro di sodio (NaCl).
in pratica le particelle di solvente (acqua H2O nell’esempio), spezzano la struttura cristallina del granello di sale, separando gli ioni costituente la molecola e mettendocisi a “guardia”, quindi il soluto verrà disperso nel solvente in maniera omogenea (ogni punto della soluzione avrà la stessa composizione di un altro).
Quindi ciò che è disperso nelle nostre vasche o sono sostanze insolubili, quindi l’acqua non è in grado di “liberare” gli ioni dei sali (ad esempio il carbonato di calcio è insolubile, se ciò non fosse i nostri amati coralli si disperderebbero nell’acqua) o ioni (cationi e anioni) derivanti dalla dissociazione di altre sostanze.
Lo ione calcio quindi potrebbe essere fornito da qualsiasi molecola che lo contenga.
Abbiamo già visto come i sali si formino dalla reazione tra cationi (originariamente derivati da idrossidi) ed anioni (residui acidi), se questi sali sono “solubili” nel solvente utilizzato, vengono separati gli ioni.
Ad esempio, se aggiungiamo del cloruro di calcio (spesso di trova nella forma biidrata, ma per semplicità di trattazione consideriamo la sua forma anidra), solubile in acqua.
CaCl2 + H2O –> Ca++ + 2Cl–
ecco che lo ione calcio sarà “liberato” e disperso nel solvente acqua e quindi reso “biodisponibile”.
Questo termine indica che può essere utilizzato da “chiunque” lo riesca a “legare” ad esempio i coralli “duri” sps ed lps lo utilizzano per formare il loro scheletro appunto secondo la seguente reazione chimica
Ca++ + CO3— –> CaCO3
Nella reazione l’anione carbonato si lega al catione calcio per formare il carbonato di calcio, insolubile. Il solvente acqua non è quindi in grado più di separare questi due ioni che rimarranno uniti a formare le barriere coralline.